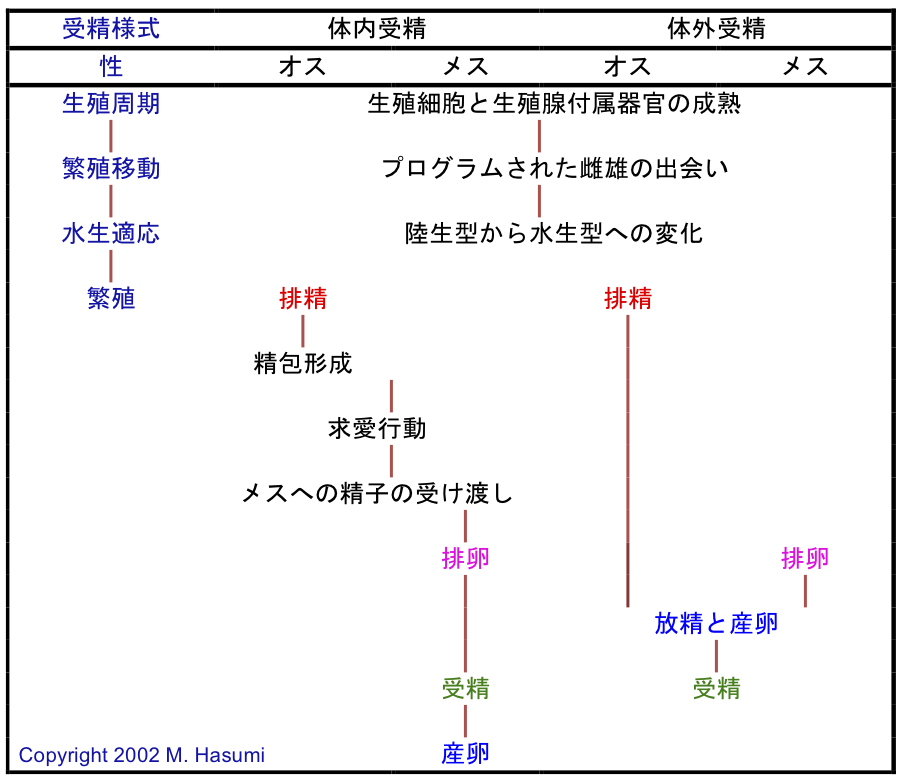
(1) 繁殖期には水中で雌雄が同時に産卵・放精し、前述のように体外受精をおこなう。しかし、Ranodon sibiricusのオスは、体外受精にもかかわらず、大きな精包をひとつだけ造るようである。つまり、山間地の渓流で、オスが先に放出した精包の上に、メスは1対の卵嚢を産出する(see Paraskiv 1953; Nussbaum, 1985; Pough et al., 2001)。その一方で、Thorn (1994)は、エゾサンショウウオと似た行動(即ち、サンショウウオ科に共通した、典型的に紋切り型の[ステレオタイプな]繁殖行動)を本種で観察している(この種の精包の有無を論じた総説に関しては、Hasumi [2015]: doi: 10.1007/s10211-015-0214-zを参照)。ちなみに、Pough et al. (2015)でも「R. sibiricusのオスは精包を造る」と記述されている。
(2) 春に冬眠から覚めた後、陸域から水域へと移動し、水中で繁殖する(有尾両生類の約70%に相当するプレトドン科には、一生を通して完全に陸生の種が含まれる。体内受精をおこなう種のなかでサンショウウオ科の種と同様の生活史を持つのが、アンビストーマ科とイモリ科の種である)。しかし、流水繁殖性のヒダサンショウウオは、毎年、秋になると水中越冬のため陸域から水域へと移動する(Kakegawa et al., 2017: doi: 10.1016/j.jcz.2017.04.003; Kakegawa and Hasumi, 2017: doi: 10.1002/rra.3162; Kakegawa and Hasumi, 2018: doi: 10.1111/azo.12222)。
(3) メスは、一腹分の未受精卵が詰まった一対の卵嚢を一度に産出する(体内受精をおこなう有尾両生類のメスは、受精卵を一個ずつ多くの場所に塊として、または塊としてではなく産出する。例えばタリカ属は卵を塊で産むが、トリトゥルス属は卵をばらばらに産む; Arntzen, 2002)。
(4) 争奪競争中のオスの関心は、産卵中、或いは産卵後のメスにではなく、一対の卵嚢に向けられる(Hasumi, 1994: doi: 10.2307/1564635; Hasumi, 2001: Stable URL)。これに対し、体内受精をおこなう有尾両生類のオスは、メスを限られた資源として認識する(Pough et al., 2001, 2015)。
(5) 止水性・流水性にかかわらず、サンショウウオ科の親による卵の保護(水中で生育する場合、主として捕食者に対する卵の保護)は、どんな形でも知られていないから、草野保博士(トウキョウサンショウウオ研究会)も私も、Nussbaum (1985)が保護の証拠として、この科の流水性2種を引用することには同意できない(比較のため、たとえばオオサンショウウオのオスは巣穴で卵をガードし、プレトドン科のサンショウウオのメスは陸上に産出した卵を抱くようにして守る)。サンショウウオ科で親による卵の保護が証明されていないこと、そしてその代替案となる対処法に関しては、Hasumi (2015)に詳しい(doi: 10.1007/s10211-015-0214-z)。
ここ30年間ほどのサンショウウオ科についての研究は、次に述べる3つの生活史に関する形質が、この科の多くの種に共通していることを示している。
(1) 特にサンショウウオ科の止水性の種に観られる水生型のオスの増大した頭幅、即ち体全体が膨らんだことで生ずる形質は、他の科では知られていない(Hasumi and Iwasawa, 1990: doi: 10.2307/1564217)。クロサンショウウオのようにオスのほうが大きいという性的サイズ二型の場合、オス間の闘争が、頭幅の増大を助長すると考えられている(Hasumi, 1994: doi: 10.2307/1564635; Alcorn et al., 2013)。これとは対照的に、キタサンショウウオのようにメスのほうが大きいという性的サイズ二型の場合、小さな体サイズのオスに観られる増大した頭幅を含めた体全体の膨らみは、より大きな体サイズのメスとの性的衝突を解消するため、繁殖期に一時的に生ずると考えられている(Hasumi, 2010: doi: 10.1007/s11692-010-9080-9)(以上の仮説に関しては、Hasumi [2015]: doi: 10.1007/s10211-015-0214-zも参照)。
(2) 他の科とは異なり、サンショウウオ科のオスには「精子変態が完了した後でも、秋と(北のほうの個体群では)冬にも『排精(即ち、精巣から輸精管への精子の排出)』が起こらない」という特徴がある(Hasumi et al., 1990: doi: 10.2307/1446342)。これが「サンショウウオ科では、秋または冬には、まだ繁殖の準備が整っていない」という形質へと繋がっている。これと同様の形質(秋の排精の不在)は、近年、キタサンショウウオでも確かめられている(Bulakhova and Berman, 2014; Yartsev and Kuranova, 2015)。これに対し、Chen et al. (2016)は「中国本土に生息するサンショウウオ属の種の多くは、冬に繁殖する」と主張している。しかし、中国産サンショウウオ類は、低緯度(南方地域)に分布することから繁殖が早まっているに過ぎないと思われる。
(3) 複合的な生活周期を持つ移動性のサンショウウオ(即ち、アンビストーマ科、サンショウウオ科、イモリ科)の中で、サンショウウオ科の種は唯一、繁殖水域近辺の陸上の冬眠場所へ向けての秋の移動をおこない、それは繁殖とは関係しない(Hasumi and Kanda, 2007: doi: 10.1655/0018-0831(2007)63[163:PAEBMP]2.0.CO;2)。この現象は「地下穴が水でズブズブの湿地帯では、サンショウウオの個体は隠れることが出来ず、そのため、もし彼らが一年を通して湿地帯に居続けるのであれば、各月で等しく捕獲されるべきである」という仮説に基づいて証明されている(Hasumi and Kanda, 2007: doi: 10.1655/0018-0831(2007)63[163:PAEBMP]2.0.CO;2)。つまり、3年間連続して9月に、捕獲個体の割合が極めて高かったということは、彼らが秋に湿地帯へ移動して来ていることを示している。サンショウウオ科のカウンターパートであるアンビストーマ科とイモリ科の中で調べられた種では、秋や冬に水域への移動が完了すると、その足で繁殖をおこなう(例えば、ブチイモリ: Healy, 1975)。但し、北のほうの種や個体群では幾つか例外があり、移動と繁殖は春にだけ見られるようである。
サンショウウオ科の種では、アンビストーマ科の種のように陸上での隠れ家として小型哺乳類が掘った地下穴を個体が利用するかどうかに関しては、お話し的な証拠しかなかった。つまり、他の動物が掘ったトンネル・システムをサンショウウオ科の種が隠れるために使用しているかどうかは、研究者の間で「たぶん、そうだろう」という推測はあっても、実際に確かめられたことはなかった(トウキョウサンショウウオのケースは、トンネルの入り口付近にいた個体からの憶測に過ぎない: Kusano and Miyashita, 1984; 草野保, 私信)。近年、モンゴル・シャーマルのキタサンショウウオで、個体が夏季の日中、一時的な隠れ家としてマスクラットが掘った穴を使用していることが確かめられた(Hasumi et al., 2009: doi: 10.1643/CP-07-237)。また、モンゴル・ダルハディンでは、サンショウウオ科では初めて、本種の陸生個体が集合行動(即ち、オス・メス・幼体などの各個体が、近距離で固まっている行動)と場所への執着(即ち、縄張りの一構成要素として、個体が特別な場所に居続けること)を持つことが示された(Hasumi et al., 2014: doi: 10.1007/s00300-013-1443-0)。
この文脈で、サンショウウオ科の種は、有尾両生類のなかでも他に類をみない唯一の存在である。これらの52%(47/90種: Frost, 2022)は日本固有のものだから(他の地域で新種の数が増加していることもあって、このパーセンテージは、かつての約50%から減って来ていたが、2018〜2019年の新種記載で元に戻っている)、私たち日本の生物学者は世界中で最も有利な立場にある。しかるに、サンショウウオ科の種が存在することの進化的な意義に、依然として気付いていない人が多い。このことが、日本の学術研究社会のなかでサンショウウオ研究の発展を妨げているのは、火をみるより明らかである。
また、両生類の個体群の多くは不運にも開発や環境汚染(例えば奇形)などの人間が引き起こす圧力による影響を受け、ここ30年間で減少しているのが現状である(カエル探偵団)。ところが、私たちには、サンショウウオ科の種の生活史戦略に関する理解(どのように生きているのか、ということの基本的な知識)が絶対的に欠如している。それなのに幾ら保全保護の方策を講じてみても、その成功は限られてしまうだろう。野外研究をおこなう科学者の誰もが、繁殖生態学・行動生態学・進化生態学といった基礎研究よりも寧ろ「環境や保護に関する応用研究に従事すべきである」という時代の潮流を私は懸念している。
従って、サンショウウオ科の種にみられる上述の進化的に既知の特質と、研究概要の項で述べる新たに分かった特質を熟慮した上で、今後の研究がおこなわれることを推奨するものである。 当ホームページが、サンショウウオ科の種を取り扱う研究で、その目的を明らかにするための一助となれば、それに越したことはない。
*2007年7月18日「キタサンショウウオ(サンショウウオ目: サンショウウオ科)が、体内受精をおこなう」と主張している、奇妙な灰色の文献(Kuranova and Saveliev, 2006)を見つけた。著者は「7月初旬に交尾をおこない、精子はメスの輸卵管内で見つかる」と述べている(水中での繁殖期は4〜5月)。また「メスは、精子または受精卵を春まで輸卵管内に貯える」とも述べている。その日の内に、この文献のことを「David M. Sever博士(Southeastern Louisiana University, USA)」に尋ねてみた。彼は、両生類と爬虫類の繁殖に関する世界最高のエキスパートである(Sever, 2002)。彼のコメントは以下のようなものであった(彼は、自分のコメントをホームページで引用することを許可してくれた)。
彼らの発見には懐疑的である。輸卵管内のマークされた精子のイラストは、とても信用できるような代物ではなく、図5で示された精子の写真は、精巣か輸精管に由来するものだろう。もしサンショウウオ科の種で「輸卵管内に精子を貯える」というのが本当であれば、とても面白いと思うが、彼らの発見には確認が必要である。
私は、彼の見解に同意する。しかし、仮にキタサンショウウオの輸卵管内での精子の貯留が本当であったとしても、私には、この種の求愛行動を想像することすら出来ない。精包を造らず、体外受精をおこなう動物で、メスへの精子の受け渡しが(陸上で?)一体どうやったら可能なのだろう。また、このサンショウウオ科の種に、なぜ著者が「newt」という用語を使ったのかも理解できないでいる。私は1年間ほど前述の疑問に言及することを見合わせて来たが、今ここに自信を持って疑問を呈する次第である。
最近、Bulakhova and Berman (2014)は、キタサンショウウオのオスの生殖周期(精巣と輸精管の季節変化に限定したもの)と水中での繁殖行動を調べ、陸上での体内受精の可能性(Kuranova and Saveliev, 2006)を否定した。しかし、匿名ではないレフェリーとしての私の見方では、生殖周期と繁殖行動を示すことは、陸上での体内受精という仮説に反駁するのに充分とは言えないものであった。また、残念なことに「この仮説を否定したいのなら、オスの総排出腔腺を調べ、精包を造ることが可能かどうかを確かめるべきである」という私の査読意見に、彼らが従うことはなかった。ちなみに、クロサンショウウオと同様に(Hasumi et al., 1990: doi: 10.2307/1446342)、精巣の頭尾軸に沿って精子形成の波が観られないことが、キタサンショウウオでも確かめられている(Bulakhova and Berman, 2014)。
キタサンショウウオでは陸上での体内受精が仮説付けられているが(Kuranova and Saveliev, 2006)、Yartsev and Kuranova (2015)は「調べられた他のサンショウウオ科の種で示されているように、キタサンショウウオの繁殖形質の総てが、この種は体外受精様式だけを採用しているということを示唆する」と結論付けている。ちなみに、クロサンショウウオやハクバサンショウウオのように(Hasumi, 1996: Stable URL)、キタサンショウウオのメスでも、卵黄蓄積過程で、7月の卵巣卵が萌葱色(ミントグリーン)を呈することが確かめられた(Yartsev and Kuranova, 2015)。クロサンショウウオでミントグリーンを呈する卵巣卵が、緑藻が繁茂する池でカモフラージュの役割を果たしているというHasumi (1996)の示唆(Mathis, 1997による紹介)に言及することなく、Muto et al. (2017)は、本種の緑色の卵で緑藻の共生を示した。
Alcorn, M. A., J. Deitloff, S. P. Graham, and E. K. Timpe. 2013. Sexual dimorphism in head shape, relative head width, and body size of Eurycea aquatica and Eurycea cirrigera. Journal of Herpetology 47: 321-327.
Arntzen, J. W. 2002. Seasonal variation in sex ratio and asynchronous presence at ponds of male and female Triturus newts. Journal of Herpetology 36: 30-35.
Bulakhova, N. A., and D. I. Berman. 2014. Male reproductive cycle of the Siberian salamander Salamandrella keyserlingii (Caudata: Hynobiidae) in coastal tundra of the Sea of Okhotsk. Polar Biology 37: 123-133.
Chen, C., J. Yang, Y. Wu, Z. Fan, W. Lu, S. Chen, and L. Yu. 2016. The breeding ecology of a critically endangered salamander, Hynobius amjiensis (Caudata: Hynobiidae), endemic to eastern China. Asian Herpetological Research 7: 53-58.
Dowling, H. G., and W. E. Duellman. 1973. Systematic Herpetology: A Synopsis of Families and Higher Categories. HISS Publications, New York, New York, U.S.A.
Duellman, W. E., and L. Trueb. 1986. Biology of Amphibians. McGraw-Hill, New York, New York, U.S.A.
Frost, D. R. 2022. Amphibian Species of the World, an Online Reference. Version 6.1 (Date of access: 28 April 2022). American Museum of Natural History, New York, U.S.A.
Hasumi, M. 1994. Reproductive behavior of the salamander Hynobius nigrescens: monopoly of egg sacs during scramble competition. Journal of Herpetology 28: 264-267.
Hasumi, M. 1996. Seasonal fluctuations of female reproductive organs in the salamander Hynobius nigrescens. Herpetologica 52: 598-605.
Hasumi, M. 2001. Sexual behavior in female-biased operational sex ratios in the salamander Hynobius nigrescens. Herpetologica 57: 396-406.
Hasumi, M. 2010. Age, body size, and sexual dimorphism in size and shape in Salamandrella keyserlingii (Caudata: Hynobiidae). Evolutionary Biology 37: 38-48.
Hasumi, M. 2015. Social interactions during the aquatic breeding phase of the family Hynobiidae (Amphibia: Caudata). Acta Ethologica 18: 243-253.
Hasumi, M., T. Hongorzul, and M. Nakagawa. 2014. Aggregation and site tenacity under downed logs in Salamandrella keyserlingii (Caudata: Hynobiidae). Polar Biology 37: 459-470.
Hasumi, M., T. Hongorzul, and K. Terbish. 2009. Burrow use by Salamandrella keyserlingii (Caudata: Hynobiidae). Copeia 2009: 46-49.
Hasumi, M., and H. Iwasawa. 1990. Seasonal changes in body shape and mass in the salamander, Hynobius nigrescens. Journal of Herpetology 24: 113-118.
Hasumi, M., H. Iwasawa, and Y. Nagahama. 1990. Seasonal dynamics of reproductive organs in male salamanders of the species Hynobius nigrescens. Copeia 1990: 367-377.
Hasumi, M., and F. Kanda. 2007. Phenological activity estimated by movement patterns of the Siberian salamander near a fen. Herpetologica 63: 163-175.
Healy, W. R. 1975. Breeding and postlarval migrations of the red-spotted newt, Notophthalmus viridescens, in Massachusetts. Ecology 56: 673-680.
Kakegawa, M., and M. Hasumi. 2017. Effects of controlled water temperatures on oviposition in a lotic-breeding and externally fertilizing salamander (Hynobius kimurae). River Research and Applications 33: 1036-1043.
Kakegawa, M., and M. Hasumi. 2018. A lotic-breeding salamander (Hynobius kimurae) modifies physiological and morphological traits during wintering. Acta Zoologica 99: 357-366.
Kakegawa, M., F. Kishi, Y. Saikawa, and M. Hasumi. 2017. Seasonal changes in body shape and mass in a lotic-breeding and externally fertilizing salamander Hynobius kimurae. Zoologischer Anzeiger 268: 55-63.
Kuranova, V. N., and S. V. Saveliev. 2006. Reproductive cycles of the Siberian newt Salamandrella keyserlingii Dybowsky, 1870, pp. 73-76. In: Herpetologia Bonnensis II. Proceedings of the 13th Congress of the Societas Europaea Herpetologica. M. Vences, J. Koehler, T. Ziegler, and W. Boehme (eds.). Alexander Koenig Museum, Bonn, Germany.
Kusano, T., and K. Miyashita. 1984. Dispersal of the salamander, Hynobius nebulosus tokyoensis. Journal of Herpetology 18: 349-353.
Larson, A., and W. W. Dimmick. 1993. Phylogenetic relationships of the salamander families: an analysis of congruence among morphological and molecular characters. Herpetological Monographs 7: 77-93.
Mann, T. 1984. Spermatophores. Springer-Verlag, Berlin, Germany.
Mathis, A. 1997. More Herpeto-trivia. HL Comunications (The Newsletter of the Herpetologists' League) 4(1): 7.
Min, M. S., S. Y. Yang, R. M. Bonett, D. R. Vieites, R. A. Brandon, and D. B. Wake. 2005. Discovery of the first Asian plethodontid salamander. Nature 435: 87-90.
Muto, K., K. Nishikawa, R. Kamikawa, and H. Miyashita. 2017. Symbiotic green algae in eggs of Hynobius nigrescens, an amphibian endemic to Japan. Phycological Research 65: 171-174.
Nussbaum, R. A. 1985. The evolution of parental care in salamanders. Miscellaneous Publications of the Museum of Zoology, University of Michigan 169: 1-50.
Paraskiv, K. P. 1953. Semirechensk salamander. Izvestiya Akademii Nauk Kazakhskoi SSR Seiya Biologicheskaya 8: 47-56 (in Russian).
Pough, F. H., R. M. Andrews, J. E. Cadle, M. L. Crump, A. H. Savitzky, and K. D. Wells. 2001. Herpetology, 2nd edition. Prentice-Hall, Upper Saddle River, New Jersey, U.S.A.
Pough, F. H., R. M. Andrews, M. L. Crump, A. H. Savitzky, K. D. Wells, and M. C. Brandley. 2015. Herpetology, 4th edition. Sinauer Associates, Inc., Sunderland, Massachusetts, U.S.A.
Pyron, R. A., and J. J. Wiens. 2011. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. Molecular Phylogenetics and Evolution 61: 543-583.
Reinhard, S., S. Voitel, and A. Kupfer. 2013. External fertilisation and paternal care in the paedomorphic salamander Siren intermedia Barnes, 1826 (Urodela: Sirenidae). Zoologischer Anzeiger 253: 1-5.
Romer, A. S., and T. S. Parsons. 1977. The Vertebrate Body, 5th edition. W. B. Saunders, Philadelphia, Pennsylvania, U.S.A.
Sever, D. M. 2002. Female sperm storage in amphibians. Journal of Experimental Zoology 292: 165-179.
Thorn, R. 1994. Courtship behavior, fertilization of eggs, and rearing in captivity of the Semirechensk salamander Ranodon sibiricus Kessler (Amphibia, Caudata). Russian Journal of Herpetology 1: 86-90.
Wake, M. H., and R. Dickie. 1998. Oviduct structure and function and reproductive modes in amphibians. Journal of Experimental Zoology 282: 477-506.
Yartsev, V. V., and V. N. Kuranova. 2015. Seasonal dynamics of male and female reproductive systems in the Siberian salamander, Salamandrella keyserlingii (Caudata, Hynobiidae). Asian Herpetological Research 6: 169-183.